
- লেখক Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- সর্বশেষ পরিবর্তিত 2025-06-01 05:03.
ইলেকট্রনের একক জোড়ার উপস্থিতির কারণে, হাইড্রাইডস এই উপাদানগুলির হয় মৌলিক (লুইস ঘাঁটি) প্রকৃতিতে। দ্য মৌলিকতা হ্রাস পায় বৃহৎ আয়তনের উপর ইলেকট্রনের প্রসারণের কারণে কেন্দ্রীয় পরমাণুর আকারের সাথে অর্থাৎ গ্রুপের নিচে , উপাদানগুলির আকার উপাদানের ইলেক্ট্রন ঘনত্ব বৃদ্ধি করে হ্রাস পায়.
এখানে, কেন অক্সাইডের মৌলিকতা গ্রুপে বৃদ্ধি পায়?
একটি পরমাণুর ক্ষমতা "একটি ইলেকট্রন গ্রহণ করার" গ্রুপের নিচে কমে যায় তাই বৃদ্ধি পায় উপাদানগুলির প্রবণতা ভাল লুইস ঘাঁটি (একটি লুইস বেস একটি ইলেক্ট্রন-জোড়া দাতা মনে করুন)। এইভাবে ইলেক্ট্রন সখ্যতা হ্রাস গ্রুপের নিচে মানে উপাদানগুলি গ্রহণ করার পরিবর্তে সহজেই একটি ইলেকট্রন দান করে।
এছাড়াও জেনে নিন, গ্রুপের নিচের অক্সাইডের মৌলিক চরিত্রের কী ঘটে এবং কেন? অম্লীয় অক্সাইডের চরিত্র হ্রাস গ্রুপের নিচে : অম্লীয় চরিত্র এর অক্সাইড কমে যায় গ্রুপের নিচে কারণ ইলেক্ট্রোনেগেটিভিটি কমে যায় গ্রুপের নিচে . বৈদ্যুতিক ঋণাত্মকতা হল ইলেকট্রন জোড়াকে আকর্ষণ করার জন্য উপাদানের সম্পত্তি। যখন ধাতুটি আরও ইলেক্ট্রোপজিটিভ হয়, তখন এটি আরও বেশি থাকে মৌলিক অক্সাইড ভিতরে প্রকৃতি.
লোকেরা আরও জিজ্ঞাসা করে, হাইড্রাইডের স্থায়িত্ব কেন গ্রুপে কমে যায়?
দ্য হাইড্রাইডের স্থায়িত্ব হ্রাস পায় অ্যামোনিয়া থেকে বিসমুথিনে। এর কারণ হল কেন্দ্রীয় পরমাণু E আকারে বৃদ্ধি পায় গ্রুপের নিচে . কেন্দ্রীয় পরমাণুর আকার বৃদ্ধির সাথে সাথে, E - H বন্ধন দুর্বল হয়ে পড়ে। যেখানে E হল নাইট্রোজেন, ফসফরাস, আর্সেনিক, অ্যান্টিমনি, বিসমাথ।
কেন একটি পিরিয়ড বরাবর মৌলিক চরিত্র হ্রাস?
চলন্ত একটি সময়কাল বরাবর , ইলেকট্রন হারানোর প্রবণতা হ্রাস পায় এবং এইভাবে, ধাতব চরিত্র কমে যায় . তাই বলা যায়, একটি সময়কাল বরাবর বাম থেকে ডানে মৌলিক চরিত্র হ্রাস পায় নিচের দিকে যাওয়ার সময়, মৌলিক চরিত্র বৃদ্ধি পায় ধাতব বৃদ্ধির কারণে চরিত্র.
প্রস্তাবিত:
প্রতি 100 মিটার তাপমাত্রা কত কমে যায়?

ট্রপোস্ফিয়ারে "স্ট্যান্ডার্ড এনভায়রনমেন্টাল" (বাতাস নিজেই উপরে বা নিচে চলে যাচ্ছে না) তাপমাত্রার হার (হ্রাস) হল ~2 ডিগ্রি সেলসিয়াস (3.5 ডিগ্রি ফারেনহাইট) প্রতি 1000 ফুট উচ্চতায় বৃদ্ধি। 1000 ফুট হল ~305 মিটার। উচ্চতায় 100 মিটার বৃদ্ধির ফলে তাপমাত্রা 2/3 ডিগ্রি সেলসিয়াস হ্রাস পাবে
বায়ুমণ্ডলে কি অক্সিজেন কমে যাচ্ছে?

বায়ুমণ্ডলীয় অক্সিজেনের মাত্রা হ্রাস পাচ্ছে জীবাশ্ম-জ্বালানি পোড়ানোর কারণে বিশ্বব্যাপী অক্সিজেনের মাত্রা হ্রাস পাচ্ছে। পরিবর্তনগুলি মানুষের স্বাস্থ্যের উপর প্রভাব ফেলতে খুব ছোট, কিন্তু জলবায়ু পরিবর্তন এবং কার্বন ডাই অক্সাইডের অধ্যয়নের জন্য আগ্রহী
সালোকসংশ্লেষণে শোষণ কমে যায় কেন?

নীল আলো: সময়ের সাথে সাথে শোষণের মান হ্রাস পাবে কারণ নীল আলো সালোকসংশ্লেষণের জন্য ক্যারোটিনয়েড এবং ক্লোরোফিল বি শোষণ করে। এভাবে DCPI কমে যাবে এবং সময়ের সাথে সাথে নীল থেকে বর্ণহীন হয়ে যাবে
কোন বিভাজনের সময় মিয়োসিসে ক্রোমোজোমের সংখ্যা কমে যায়?
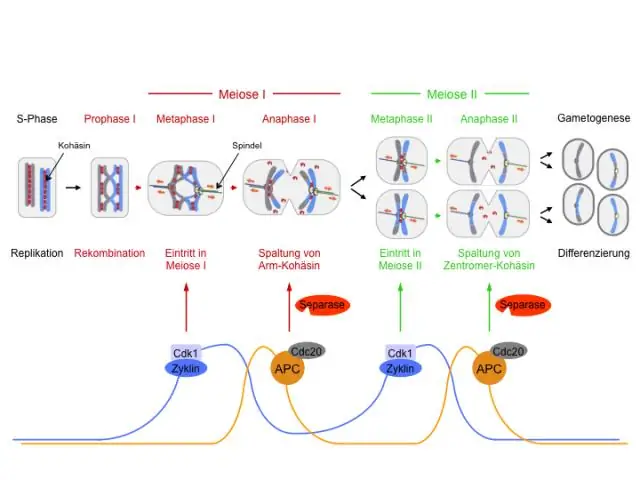
প্রথম বিভাগটিকে হ্রাস বিভাগ বলা হয় - বা মিয়োসিস I - কারণ এটি 46 ক্রোমোজোম বা 2n থেকে 23 ক্রোমোজোম বা n (n একটি একক ক্রোমোজোম সেট বর্ণনা করে) ক্রোমোজোমের সংখ্যা হ্রাস করে।
অ্যামাইনের মৌলিকত্ব কি?

অ্যামাইনের বেসিসিটি অ্যামাইনগুলি মৌলিক কারণ তাদের এক জোড়া অপরিশোধিত ইলেকট্রন রয়েছে, যা তারা অন্যান্য পরমাণুর সাথে ভাগ করতে পারে। এই শেয়ার না করা ইলেকট্রন নাইট্রোজেন পরমাণুর চারপাশে একটি ইলেকট্রন ঘনত্ব তৈরি করে। ইলেকট্রনের ঘনত্ব যত বেশি, মৌলিক অণু তত বেশি
