
- লেখক Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- সর্বশেষ পরিবর্তিত 2025-01-22 16:56.
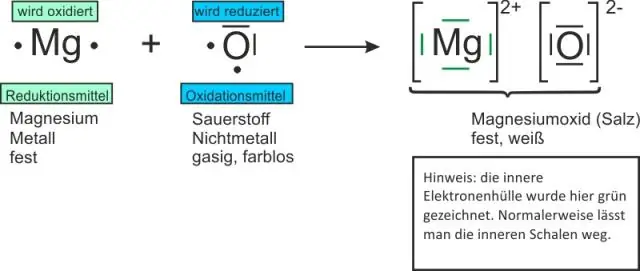
দ্য পারমাণবিক সংখ্যা প্রতিনিধিত্ব করে সংখ্যা একটি মধ্যে প্রোটন এর পরমাণুর নিউক্লিয়াস. একটি মধ্যে চার্জহীন পরমাণু , দ্য সংখ্যা প্রোটন সবসময় সমান হয় ইলেকট্রন সংখ্যা . উদাহরণস্বরূপ, কার্বন পরমাণু ছয়টি প্রোটন এবং ছয়টি অন্তর্ভুক্ত ইলেকট্রন , তাই কার্বন এর পারমাণবিক সংখ্যা হল 6।
একইভাবে, আপনি জিজ্ঞাসা করতে পারেন, আপনি কীভাবে ইলেকট্রনের সংখ্যা খুঁজে পান?
দ্য ইলেকট্রন সংখ্যা একটি নিরপেক্ষ পরমাণু মধ্যে সমান সংখ্যা প্রোটন এর ভর সংখ্যা পরমাণুর (M) যোগফলের সমান সংখ্যা নিউক্লিয়াসে প্রোটন এবং নিউট্রন। দ্য সংখ্যা নিউট্রন ভরের মধ্যে পার্থক্যের সমান সংখ্যা পরমাণুর (M) এবং পরমাণু সংখ্যা (Z)।
কেউ জিজ্ঞাসা করতে পারে, 235u এর একটি পরমাণুতে কতটি ইলেকট্রন আছে? 235U(4+), উদাহরণস্বরূপ, থাকবে 92 - 4 = 88 ইলেকট্রন। প্রতীকে প্রদত্ত ভর সংখ্যা থেকে প্রোটনের সংখ্যা বিয়োগ করে আইসোটোপে নিউট্রনের সংখ্যা নির্ণয় করুন। উদাহরণস্বরূপ, 235U, যা রয়েছে 92 প্রোটন, তাই 235 ধারণ করে - 92 = 143 নিউট্রন।
এছাড়াও প্রশ্ন হল, আমি কীভাবে একটি চার্জহীন বা নিরপেক্ষ পরমাণুতে প্রোটন নিউট্রন এবং ইলেকট্রনের সংখ্যা নির্ধারণ করতে পারি?
সংখ্যা এর নিউট্রন ভরের সমান সংখ্যা এর পরমাণু বিয়োগ পারমাণবিক সংখ্যা . দ্য পারমাণবিক সংখ্যা এবং গড় পারমাণবিক ভর (ভরের ওজনযুক্ত গড় সংখ্যা সমস্ত আইসোটোপ) পর্যায় সারণীতে পাওয়া যাবে। সংখ্যা এর ইলেকট্রন ভিতরে নিরপেক্ষ পরমাণু এবং আইসোটোপ সমান প্রোটন সংখ্যা.
কেন একটি পরমাণু চার্জহীন?
স্বাভাবিক পরমাণু বৈদ্যুতিক হয় চার্জহীন বা নিরপেক্ষ। ইলেকট্রন, তারা একটি ঋণাত্মক চার্জ গ্রহণ করে কারণ প্রতিটি পরমাণু এখন প্রোটনের চেয়ে বেশি ইলেকট্রন আছে। স্থিতিশীল এবং বর্তমান বিদ্যুৎ উভয়ই ঋণাত্মকভাবে চার্জ করা ইলেকট্রনের গতিবিধি দ্বারা ব্যাখ্যা করা যেতে পারে পরমাণু ইতিবাচকভাবে চার্জ করা পরমাণু একটি ভারসাম্য অর্জন না হওয়া পর্যন্ত।
প্রস্তাবিত:
গড় দেওয়া হলে আপনি কিভাবে অনুপস্থিত সংখ্যা খুঁজে পাবেন?

সংখ্যার সেটের গড় হল সেই সংখ্যাগুলির গড়। আপনি সংখ্যার সেট যোগ করে এবং কয়টি সংখ্যা দেওয়া হয়েছে তা দিয়ে ভাগ করে অর্থ খুঁজে পেতে পারেন। যদি আপনাকে থিম দেওয়া হয় এবং সেট থেকে একটি অনুপস্থিত সংখ্যা খুঁজে পেতে বলা হয়, তাহলে একটি সাধারণ সমীকরণ ব্যবহার করুন
আপনি কিভাবে একটি রাসায়নিক সূত্রে অণুর সংখ্যা খুঁজে পাবেন?
অ্যাভোগাড্রো ধ্রুবক দ্বারা মোলগুলিকে গুণ করুন আপনার নমুনায় অণুর সংখ্যা গণনা করতে অ্যাভোগাড্রো ধ্রুবক, 6.022 x 10^23 দ্বারা মোলের সংখ্যাকে গুণ করুন
আপনি কিভাবে H NMR এ শিখরের সংখ্যা খুঁজে পাবেন?

ভিডিও এই বিবেচনায় রেখে, এনএমআরের শিখরগুলি কী কী? ক শিখর একটি রাসায়নিক পরিবর্তনে, বলুন, 2.0 এর মানে হল যে হাইড্রোজেন পরমাণু যা ঘটিয়েছে শিখর অনুরণন তৈরির জন্য TMS-এর যে ক্ষেত্রের প্রয়োজন তার চেয়ে দুই মিলিয়ন ভাগ কম একটি চৌম্বক ক্ষেত্র প্রয়োজন। ক শিখর 2.
আপনি কিভাবে ইলেকট্রনের সর্বোচ্চ সংখ্যা খুঁজে পাবেন?

প্রতিটি সম্পূর্ণ অরবিটালের জন্য ইলেকট্রন যোগ করুন প্রতিটি পূর্ণ অরবিটাল ধরে রাখতে পারে এমন সর্বোচ্চ সংখ্যক ইলেকট্রন যোগ করুন। পরবর্তী ব্যবহারের জন্য এই সংখ্যাটি রেকর্ড করুন। উদাহরণ, প্রথম অরবিটাল দুটি ইলেকট্রন ধারণ করতে পারে; দ্বিতীয়টি, আটটি; এবং তৃতীয়টি, 18. সুতরাং তিন অরবিটালগুলি 28টি ইলেকট্রন ধারণ করতে পারে
আপনি কিভাবে পরমাণুর শতাংশ খুঁজে পাবেন?
একটি উপাদানের ভর শতাংশ রচনা খুঁজে পেতে, মৌলের ভর অবদানকে মোট আণবিক ভর দিয়ে ভাগ করুন। শতাংশ হিসাবে প্রকাশ করার জন্য এই সংখ্যাটিকে 100% দ্বারা গুণ করতে হবে
