
- লেখক Miles Stephen [email protected].
- Public 2023-12-15 23:34.
- সর্বশেষ পরিবর্তিত 2025-01-22 16:56.
লুইস আঁকুন মধ্যে পৃথক পরমাণুর প্রতীক অণু . পরমাণুকে এমনভাবে একত্রিত করুন যাতে প্রতিটি পরমাণুর চারপাশে আটটি ইলেকট্রন থাকে (বা H এর জন্য দুটি ইলেকট্রন, হাইড্রোজেন ) যেখানে সম্ভব. ভাগ করা ইলেকট্রনের প্রতিটি জোড়া হল a সমযোজী বন্ধন যা একটি ড্যাশ দ্বারা প্রতিনিধিত্ব করা যেতে পারে।
এই বিষয়ে, আপনি কিভাবে একটি যৌগের জন্য একটি লুইস কাঠামো আঁকবেন?
এই নির্দেশাবলী অণুর জন্য লুইস কাঠামো আঁকতে কেল্টার কৌশলের রূপরেখা দেয়।
- ধাপ 1: ভ্যালেন্স ইলেকট্রনের মোট সংখ্যা খুঁজুন।
- ধাপ 2: পরমাণুগুলিকে "সুখী" করতে প্রয়োজনীয় ইলেকট্রনের সংখ্যা খুঁজুন
- ধাপ 3: অণুতে বন্ডের সংখ্যা নির্ধারণ করুন।
- ধাপ 4: একটি কেন্দ্রীয় পরমাণু চয়ন করুন।
এছাড়াও জানুন, আপনি কিভাবে বন্ড অর্ডার পাবেন? যদি অণুতে দুটির বেশি পরমাণু থাকে তবে বন্ড অর্ডার নির্ধারণ করতে এই পদক্ষেপগুলি অনুসরণ করুন:
- লুইস কাঠামো আঁকুন।
- বন্ডের মোট সংখ্যা গণনা করুন।
- পৃথক পরমাণুর মধ্যে বন্ড গ্রুপের সংখ্যা গণনা করুন।
- অণুর মধ্যে বন্ড গ্রুপের মোট সংখ্যা দ্বারা পরমাণুর মধ্যে বন্ধনের সংখ্যা ভাগ করুন।
একইভাবে কেউ প্রশ্ন করতে পারে, সমযোজী বন্ধন কোন কাঠামো গঠন করে?
সমযোজী বন্ধনের দুটি পরমাণু জড়িত, সাধারণত অধাতু, যা ইলেক্ট্রনের ঘনত্ব ভাগ করে ফর্ম শক্তিশালী বন্ধন মিথস্ক্রিয়া। সমযোজী বন্ধনের একক, ডবল এবং ট্রিপল অন্তর্ভুক্ত বন্ড এবং সিগমা এবং পাই বন্ধন মিথস্ক্রিয়া দ্বারা গঠিত যেখানে যথাক্রমে 2, 4, বা 6 ইলেকট্রন ভাগ করা হয়।
bf3 এর গঠন কি?
এর অণুর জ্যামিতি BF3 হল 'ত্রিকোণীয় প্ল্যানার। রসায়নের রেফারেন্সে, 'ট্রাইগোনাল প্ল্যানার' হল একটি মডেল যার মাঝখানে একটি পরমাণুর চারপাশে তিনটি পরমাণু রয়েছে। এটি একটি সমতলে পেরিফেরাল পরমাণুর মতো, কারণ তাদের তিনটিই 120° বন্ধন কোণের সাথে সমান যা তাদের একটি সমবাহু ত্রিভুজ করে।
প্রস্তাবিত:
আপনি কিভাবে একটি বিনামূল্যে শরীরের চিত্র আঁকবেন?

একটি ফ্রি-বডি ডায়াগ্রাম আঁকতে, আমরা আগ্রহের বস্তুটি আঁকি, সেই বস্তুর উপর ক্রিয়াশীল সমস্ত শক্তি আঁকি এবং সমস্ত বল ভেক্টরকে x– এবং y- উপাদানগুলিতে সমাধান করি। সমস্যায় থাকা প্রতিটি বস্তুর জন্য আমাদের অবশ্যই একটি পৃথক ফ্রি-বডি ডায়াগ্রাম আঁকতে হবে
আপনি কিভাবে একটি বেগ বনাম সময় গ্রাফ আঁকবেন?
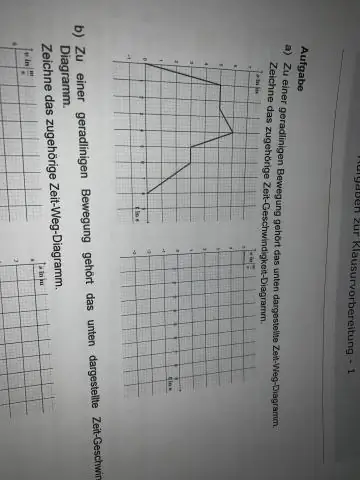
গ্রাফ পেপারে দুটি সরল রেখা আঁকুন যা একই বিন্দুতে উৎপন্ন এবং একে অপরের সাথে লম্ব। এটি হল x-y অক্ষ। x-অক্ষ হল অনুভূমিক রেখা এবং y-অক্ষ হল উল্লম্ব রেখা। x-অক্ষে উপযুক্ত সমান-ব্যবধানের সময় ব্যবধান চিহ্নিত করুন যাতে আপনি টেবিল থেকে সময়ের মানগুলি সহজেই গ্রাফ করতে পারেন
লুইস অ্যাসিড একটি লুইস বেসের সাথে বিক্রিয়া করলে কোন ধরনের বন্ধন তৈরি হয়?

সমযোজী বন্ধন সমন্বয়
আপনি বাইনারি সমযোজী যৌগের নাম কিভাবে করবেন?

বাইনারি সমযোজী যৌগগুলির নামকরণ পর্যায় সারণির বাম দিকের অ-ধাতুকে তার মৌলিক নাম অনুসারে নাম দিন। অন্যান্য অ-ধাতুর নাম তার মৌলিক নাম এবং একটি -ide শেষ দিয়ে নাম দিন। উপসর্গ mono-, di-, tri- ব্যবহার করুন। অণুতে সেই উপাদানটির সংখ্যা নির্দেশ করতে। mono প্রথম উপসর্গ হলে, এটি বোঝা যায় এবং লেখা হয় না
সমস্ত আয়নিক যৌগের কি একটি জালি কাঠামো আছে?

একটি আয়নিক যৌগ হল আয়নগুলির একটি বিশাল কাঠামো। আয়নগুলির একটি নিয়মিত, পুনরাবৃত্তিমূলক বিন্যাস থাকে যাকে আয়নিক জালি বলা হয়। এই কারণেই কঠিন আয়নিক যৌগগুলি নিয়মিত আকারের সাথে স্ফটিক গঠন করে
