
- লেখক Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- সর্বশেষ পরিবর্তিত 2025-01-22 16:56.
এই সব বন্ধন জোড়া হলে আণবিক জ্যামিতি টেট্রাহেড্রাল (যেমন CH4)। যদি ইলেকট্রনের একটি একা জোড়া এবং তিনটি বন্ধন জোড়া থাকে তাহলে ফলাফল পাওয়া যায় আণবিক জ্যামিতি ত্রিকোণীয় পিরামিডাল (যেমন NH3)। যদি দুটি বন্ধন জোড়া এবং দুটি একক জোড়া ইলেকট্রন থাকে আণবিক জ্যামিতি কৌণিক বা বাঁকানো (যেমন H2O)।
এই বিষয়টি মাথায় রেখে অণুর আকৃতি কেমন?
পাঁচটি আদর্শ আকার হল: রৈখিক, ত্রিকোণীয় প্ল্যানার, টেট্রাহেড্রাল, ট্রাইগোনাল বাইপ্রামিডাল এবং অষ্টহেড্রাল। একটি গুরুত্বপূর্ণ পয়েন্ট সম্পর্কে নোট করুন আণবিক আকৃতি সমস্ত ডায়াটমিক (দুটি পরমাণু সহ যৌগ) যৌগগুলি রৈখিক। তাই H2, HCl এবং Cl2 সবই রৈখিক।
কি কারণে একটি অণুর আকৃতি টেট্রাহেড্রাল হতে পারে? ক অণু হয় টেট্রাহেড্রাল যদি কেন্দ্রীয় পরমাণুর চারটি বন্ধন থাকে এবং একা জোড়া না থাকে। ব্যাখ্যা: একটি সাধারণ উদাহরণ হল a অণু মিথেনের (ছবি দেখুন)। বন্ডের ইলেকট্রন জোড়া অন্য বন্ডের ইলেকট্রনকে বিকর্ষণ করে, তাই তারা সবাই একে অপরের থেকে যতটা সম্ভব দূরে যাওয়ার চেষ্টা করে।
ফলস্বরূপ, আপনি কিভাবে আণবিক আকৃতি খুঁজে পাবেন?
অণুর আকৃতি খুঁজে পেতে ব্যবহৃত পদক্ষেপগুলি
- লুইস কাঠামো আঁকুন।
- ইলেক্ট্রন গোষ্ঠীর সংখ্যা গণনা করুন এবং তাদের ইলেকট্রন গ্রুপের বন্ধন জোড়া বা ইলেকট্রনের একক জোড়া হিসাবে চিহ্নিত করুন।
- ইলেকট্রন-গ্রুপ জ্যামিতির নাম দাও।
- কেন্দ্রের চারপাশে অন্যান্য পারমাণবিক নিউক্লিয়াসের অবস্থানের দিকে তাকিয়ে আণবিক জ্যামিতি নির্ধারণ করে।
অণুর 5টি মৌলিক আকৃতি কি কি?
আণবিক জ্যামিতি। ভিএসইপিআর তত্ত্বটি সাধারণ অণুর পাঁচটি প্রধান আকার বর্ণনা করে: রৈখিক, ত্রিকোণীয় প্ল্যানার, টেট্রাহেড্রাল , ত্রিকোণীয় বাইপিরামিডাল, এবং অষ্টহেড্রাল।
প্রস্তাবিত:
কেন একটি অণুর বল এবং লাঠি মডেল একটি অবাস্তব চিত্র?
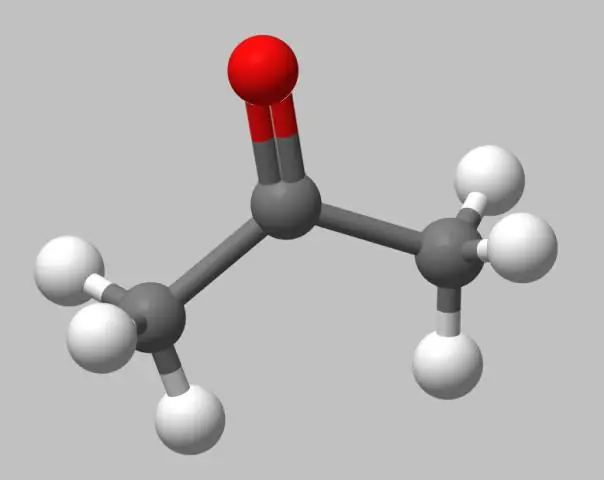
বল এবং লাঠি মডেল. বল-এবং-স্টিকের মডেলগুলি স্থান-ভর্তি মডেলগুলির মতো বাস্তবসম্মত নয়, কারণ পরমাণুগুলিকে তাদের ভ্যান ডার ওয়ালস রেডিআই থেকে ছোট রেডিআইয়ের গোলক হিসাবে চিত্রিত করা হয়েছে। যাইহোক, বন্ধন বিন্যাস দেখতে সহজ কারণ বন্ডগুলি স্পষ্টভাবে লাঠি হিসাবে উপস্থাপিত হয়
নিচের কোনটি সালফিউরিক অ্যাসিডের সাথে জলীয় অ্যামোনিয়ার প্রতিক্রিয়ার জন্য আণবিক সমীকরণটি সবচেয়ে ভাল উপস্থাপন করে?

প্রশ্ন: জলীয় অ্যামোনিয়ার সাথে জলীয় সালফিউরিক অ্যাসিডের বিক্রিয়ার সুষম সমীকরণ হল 2NH3(aq) + H2SO4 (aq) --> (NH4)2SO4(aq) A
একটি abe3 অণুর আণবিক জ্যামিতি কি?

টাইপ ইলেক্ট্রনিক জ্যামিতি আণবিক জ্যামিতি 4 অঞ্চল AB4 টেট্রাহেড্রাল টেট্রাহেড্রাল AB3E টেট্রাহেড্রাল ত্রিকোণ পিরামিডাল AB2E2 টেট্রাহেড্রাল বাঁকানো 109.5o
O2 এর আণবিক আকৃতি কি?

আণবিক জ্যামিতি A B O2 এর আকৃতি কি? রৈখিক PH3 এর আকৃতি কি? ত্রিকোণ পিরামিডাল HClO এর আকৃতি কি? বাঁকানো N2 এর আকৃতি কি? রৈখিক
রসায়নে আণবিক আকৃতি কি?

আণবিক জ্যামিতি হল পরমাণুর ত্রিমাত্রিক বিন্যাস যা একটি অণু গঠন করে। এতে অণুর সাধারণ আকৃতির পাশাপাশি বন্ধনের দৈর্ঘ্য, বন্ধন কোণ, টরসিয়াল কোণ এবং অন্য যেকোন জ্যামিতিক পরামিতি রয়েছে যা প্রতিটি পরমাণুর অবস্থান নির্ধারণ করে।
