
- লেখক Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- সর্বশেষ পরিবর্তিত 2025-01-22 16:56.
একটি পরমাণু যে লাভ ক নেতিবাচক ইলেকট্রন , এটা হয়ে যায় ক নেতিবাচক আয়ন যদি এটা একটি ইলেকট্রন হারায় এটা হয়ে যায় একটি ইতিবাচক আয়ন। এটি তার একটি হারাতে পারে ইলেকট্রন , এটি একটি আয়ন তৈরীর. এটিতে এখন এর চেয়ে বেশি ইতিবাচক প্রোটন রয়েছে ইলেকট্রন তাই এটি একটি সামগ্রিক ইতিবাচক চার্জ আছে.
এর ফলে, কেন একটি পরমাণু যা ইলেকট্রন লাভ করে নেতিবাচকভাবে চার্জিত হয়?
কিছু পরমাণু প্রায় আট আছে ইলেকট্রন তাদের ভ্যালেন্স শেলে এবং অতিরিক্ত ভ্যালেন্স লাভ করতে পারে ইলেকট্রন যতক্ষণ না তাদের একটি অক্টেট আছে। যখন এগুলো পরমাণু লাভ করা ইলেকট্রন , তারা একটি অর্জন নেতিবাচক চার্জ কারণ তারা এখন আরও বেশি অধিকারী ইলেকট্রন প্রোটনের চেয়ে। নেতিবাচকভাবে অভিযুক্ত আয়নগুলিকে অ্যানিয়ন বলা হয়।
উপরন্তু, ক্লোরিন পরমাণু একটি ইলেক্ট্রন অর্জন করলে কী ঘটে তখন একে কী বলা হয়? ১৮টি আছে ইলেকট্রন এবং 17 প্রোটন, তাই ক্লোরিন পরমাণু অভিযুক্ত হয়ে গেছে ক্লোরিন ঋণাত্মক এক (-1) চার্জ সহ আয়ন। এটা যে অতিরিক্ত লাগে যখন ইলেকট্রন , এটি একটি হয়ে যায় ক্লোরিন আয়ন, ঋণাত্মক এক (-1) চার্জ সহ।
এর পাশাপাশি, যখন একটি পরমাণু একটি ইলেকট্রন অর্জন করে তখন কি এটি একটি অ্যানায়নে পরিণত হয়?
যদি পরমাণু হারান ইলেকট্রন , তারা হয়ে ধনাত্মক আয়ন, বা ক্যাশন। যদি পরমাণু লাভ করা ইলেকট্রন , তারা হয়ে নেতিবাচক আয়ন, বা anions . ফ্লোরিনের উদাহরণ বিবেচনা করুন (নীচের চিত্র দেখুন)। একটি ফ্লোরিন পরমাণু নয়টি প্রোটন এবং নয়টি রয়েছে ইলেকট্রন , তাই এটি বৈদ্যুতিকভাবে নিরপেক্ষ।
ঋণাত্মক চার্জযুক্ত পরমাণুকে কী বলা হয়?
নেতিবাচকভাবে অভিযুক্ত বা ইতিবাচক চার্জযুক্ত পরমাণু সাধারণত ANION/CATION হিসাবে অভিহিত করা হয়। সংক্ষিপ্ত ব্যাখ্যা: যদি একটি পরমাণু ইলেকট্রন হারায় বা প্রোটন লাভ করে, এটি একটি নেট ইতিবাচক থাকবে চার্জ এবং হয় ডাকা একটি ক্যাটান যদি একটা পরমাণু ইলেকট্রন লাভ বা প্রোটন হারায়, এটি একটি নেট থাকবে নেতিবাচক চার্জ এবং হয় ডাকা একটি অ্যানিয়ন।
প্রস্তাবিত:
যখন একটি পরমাণু একটি ইলেকট্রন হারায় তখন কী ধরনের আয়ন তৈরি হয়?
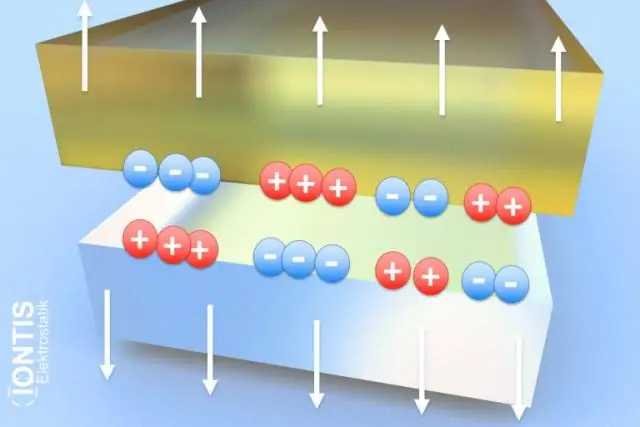
অক্টেট নিয়ম পূরণ করার জন্য পরমাণুগুলি যখন ইলেকট্রন হারায় বা লাভ করে তখন আয়নগুলি গঠিত হয় এবং সম্পূর্ণ বাইরের ভ্যালেন্স ইলেকট্রন শেল থাকে। যখন তারা ইলেকট্রন হারায়, তখন তারা ধনাত্মক চার্জে পরিণত হয় এবং তাদের নাম দেওয়া হয় ক্যাশান। যখন তারা ইলেকট্রন অর্জন করে, তখন তারা ঋণাত্মকভাবে চার্জিত হয় এবং তাদের নাম দেওয়া হয় অ্যানিয়ন
পরমাণু কি উপাদান দিয়ে তৈরি নাকি পরমাণু দিয়ে তৈরি হয়?

পরমাণু সবসময় উপাদান দিয়ে তৈরি হয়। পরমাণু কখনো কখনো উপাদান দিয়ে তৈরি হয়। তাদের সকলের পারমাণবিক প্রতীকে দুটি অক্ষর রয়েছে। একই ভর সংখ্যা আছে
ঋণাত্মক সংখ্যার ঘনমূল ঋণাত্মক সংখ্যা কেন?

একটি ঋণাত্মক সংখ্যার ঘনমূল সর্বদা ঋণাত্মক হবে যেহেতু একটি সংখ্যাকে ঘন করার অর্থ হল এটিকে 3য় ঘাতে উন্নীত করা - যা বিজোড় - ঋণাত্মক সংখ্যার ঘনমূলগুলিও ঋণাত্মক হতে হবে। যখন সুইচ বন্ধ (নীল), ফলাফল নেতিবাচক হয়. যখন সুইচ চালু থাকে (হলুদ), ফলাফল ইতিবাচক হয়
যখন আপনি একটি ঋণাত্মক দ্বারা গুণ বা ভাগ করেন তখন কেন আপনি অসমতার চিহ্নটি উল্টান?

যখন আপনি একটি ঋণাত্মক মান দ্বারা উভয় পক্ষকে গুণ করেন তখন আপনি যে দিকটি বড় তার একটি 'বড়' ঋণাত্মক সংখ্যা তৈরি করেন, যার প্রকৃত অর্থ হল এটি এখন অন্য পাশের থেকে কম! এই কারণে যখনই আপনি একটি ঋণাত্মক সংখ্যা দ্বারা গুণ করবেন তখন আপনাকে অবশ্যই চিহ্নটি উল্টাতে হবে
সোডিয়াম যখন ক্লোরিনের সাথে বিক্রিয়া করে সোডিয়াম ক্লোরাইড তৈরি করে তখন ইলেকট্রন কিসের দ্বারা হারিয়ে যায়?

যখন সোডিয়াম ক্লোরিনের সাথে বিক্রিয়া করে, তখন এটি তার এক বাইরের ইলেক্ট্রনকে ক্লোরিন পরমাণুতে স্থানান্তর করে। একটি ইলেকট্রন হারানোর মাধ্যমে, সোডিয়াম পরমাণু একটি সোডিয়াম আয়ন (Na+) গঠন করে এবং একটি ইলেকট্রন লাভ করে, ক্লোরিন পরমাণু একটি ক্লোরাইড আয়ন (Cl-) গঠন করে।
